
山東源林CO催化劑中毒、使用溫度的說明:
催化劑中毒
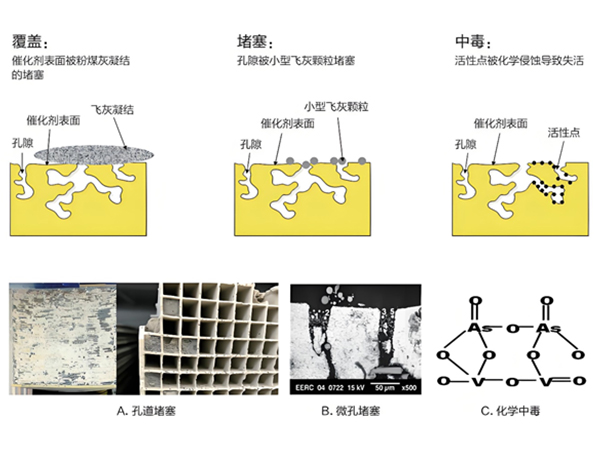
催化劑中毒的機理主要包括物理中毒、化學(xué)中毒和熱中毒。
物理中毒:煙氣中的顆粒物、重金屬等物理雜質(zhì)會覆蓋在催化劑表面,堵塞催化劑孔隙,減少氣體與催化劑的有效接觸面積。長期的物理沉積可能導(dǎo)致催化劑結(jié)構(gòu)的微小損傷,尤其是在清除沉積物時,可能會對催化劑的載體結(jié)構(gòu)造成進一步的損害。沉積物可能改變催化劑表面的熱傳導(dǎo)性能,影響催化劑在高溫環(huán)境下的穩(wěn)定性和催化活性。
化學(xué)中毒:煙氣中的化學(xué)物質(zhì)如SO?、HCl等會與催化劑的活性位點發(fā)生反應(yīng),形成穩(wěn)定的化合物,使催化劑的活性位點失去作用。例如,煙氣中的磷化合物在高溫下可能與催化劑發(fā)生反應(yīng),生成磷酸鹽,導(dǎo)致催化劑表面活性位點的喪失。
熱中毒:在高溫環(huán)境下,催化劑中的活性成分可能會發(fā)生燒結(jié),導(dǎo)致比表面積減小,催化能力下降。高溫可能導(dǎo)致催化劑中一些組分發(fā)生相變,從活性較高的晶相轉(zhuǎn)變?yōu)榛钚暂^低的晶相,這同樣會降低催化劑的活性。高溫環(huán)境下,催化劑表面的活性位點可能因燒結(jié)而數(shù)量減少,同時原有的活性位點也可能因結(jié)構(gòu)變化而失去原有的催化功能。
CO催化劑的使用溫度低
如果CO催化劑使用溫度低于要求的溫度,那么VOCs或CO在催化劑表面容易發(fā)生結(jié)焦(積炭),活性會不斷降低。如果單純的催化劑表面積炭,可通過提高催化劑溫度到350℃在空氣氛圍下進行4~12小時的熱處理可回復(fù)其活性。
低溫狀態(tài)下,大量的有機物進入催化床,附著于催化劑表面,造成催化劑“悶死”,導(dǎo)致催化劑暫時失活。其原因一方面是反應(yīng)溫度低,有機廢氣燃燒不充分;另一方面生成物逸出難度加大。當(dāng)催化劑出現(xiàn)低溫“悶死”現(xiàn)象時,應(yīng)當(dāng)通入大量的新鮮空氣,并提高催化燃燒室溫度,進行催化劑再生。
CO催化劑超高溫使用
如果CO催化劑在超高溫下使用,它表面的活性組分(鉑、鈀)會發(fā)生團聚,粒子長大,使得催化劑的有效活性位下降,催化劑活性下降。此外,高溫會造成催化劑比表面積下降,催化劑載體和助催化劑發(fā)生固相反應(yīng)等,使得催化劑活性下降。催化劑超高溫使用導(dǎo)致的催化劑性能下降是不可逆,因此在催化劑使用過程一定要避免長時間超高溫使用。
催化劑高溫失活是因為在高溫下,負(fù)載在載體上的高分散的活性組分的小晶粒,具有較大自由能,加之表面晶格質(zhì)點在加熱的情況下產(chǎn)生振動而發(fā)生位移,逐漸由小晶粒聚集為大晶粒,導(dǎo)致活性表面減小,活性降低,甚至失去活性。
對金屬催化劑,當(dāng)反應(yīng)溫度約為金屬熔點的三分之一時,就會引起金屬表面原子的遷移,當(dāng)反應(yīng)溫度高于其熔點的二分之一時,體相原子也會變得容易流動,使催化劑的燒結(jié)更加嚴(yán)重。
粉塵的影響
如果氣體中含有粉塵,小顆粒的粉塵容易進入CO催化劑微孔,使得CO催化劑性能下降,因此要保證VOCs氣體中比較低的粉塵含量。如果大顆粒粉塵在催化劑表面沉積,那么可以用高壓空氣吹掃等方式清理。
有機硅中毒
有機硅烷進入CO催化劑孔道發(fā)生反應(yīng),有機硅烷中的C元素轉(zhuǎn)化為CO?、H元素轉(zhuǎn)化為水,Si元素轉(zhuǎn)化為SiO?,由于SiO?是固體,會留在催化劑微小的孔道內(nèi),堵塞孔道,導(dǎo)致CO催化劑失活。而且,這種失活是不可逆的。因此,在VOCs處理時要避免有機硅的中毒。有機硅中毒也是不可逆的,一定要避免。
金屬有機物中毒
金屬有機化合物的中毒機理類似于有機硅。
P、F、Pb、Zn元素中毒
這些物質(zhì)對CO催化劑的中毒,目前機理還不清楚,這類物質(zhì)的中毒也是不可逆的中毒。
Cl和S中毒
對于Cl和S對CO催化劑的中毒,S對CO催化劑中毒作用很小,Cl只要不是高濃度和長時間的中毒,基本也是可逆的。但是當(dāng)含氯有機物存在時,由于含氯有機物在催化劑表面吸附很強,因此會造成催化劑性能下降。可以將催化劑溫度到350℃在空氣氛圍下(不含氯)進行4~24小時的處理,CO催化劑性能基本會恢復(fù)。如果長時間、高濃度的長時間的中毒,依然會導(dǎo)致催化劑不可逆轉(zhuǎn)的中毒的。
在催化氧化反應(yīng)過程中,電負(fù)性越強的物種越容易和金屬離子M+結(jié)合,以甲烷燃燒為例:MO+CH4——COx+H2O+M,M+O2——MO完成一個催化循環(huán)。如果有機廢氣中含有硫、鹵素,金屬離子M+與硫、鹵素會產(chǎn)生配位反應(yīng),因而破壞這催化氧化的循環(huán)鏈,造成催化劑失活。
1、化學(xué)吸附與活性位點失活
(1)硫——金屬強化學(xué)鍵形成
硫(S)通過未成對的孤對電子與過渡金屬(如Pt、Pd等)的d軌道結(jié)合,形成穩(wěn)定的S——M鍵(如PtS或PtS?),覆蓋或占據(jù)金屬活性位點,直接阻斷反應(yīng)物的吸附與活化過程。
(2)競爭吸附與活性位點覆蓋
硫化合物(如H?S、SO?)優(yōu)先吸附于催化劑表面,與反應(yīng)物(如烴類、H?)競爭活性位點,抑制目標(biāo)反應(yīng)的進行。
2、催化劑結(jié)構(gòu)破壞
(1)金屬活性成分的化學(xué)轉(zhuǎn)化
硫與金屬活性中心反應(yīng)生成熱力學(xué)穩(wěn)定的硫化物(如PtS、Ni?S?),改變金屬的電子狀態(tài)和晶格結(jié)構(gòu),導(dǎo)致活性成分不可逆失活。
(2)載體或助劑的功能削弱
硫可能侵蝕催化劑載體(如Al?O?)或與助劑(如K?O)反應(yīng),破壞酸性或堿性功能位點,間接影響金屬與酸性中心的協(xié)同作用。
3、可逆性與不可逆性中毒差異
(1)可逆中毒:硫通過可逆吸附(如PtS可逆)覆蓋活性位點,通過高溫還原或低硫環(huán)境再生。
(2)不可逆中毒:硫與金屬形成穩(wěn)定化學(xué)鍵(如PtS不可逆),需更換催化劑。
4、協(xié)同毒化效應(yīng)
(1)硫與其他毒物(如As、P)共同作用時,可能通過以下途徑加劇中毒:
(2)多毒物復(fù)合吸附:硫與砷競爭吸附于活性位點,形成更穩(wěn)定的復(fù)合毒化層(如Pt-S-As),加速失活。
(3)結(jié)構(gòu)穩(wěn)定性下降:硫誘導(dǎo)的金屬硫化物可能促進燒結(jié)或相變,降低催化劑高溫穩(wěn)定性。
瀏覽次數(shù):79
瀏覽次數(shù):117
瀏覽次數(shù):133
瀏覽次數(shù):252
瀏覽次數(shù):482